近日,国家儿童医学中心、首都医科大学附属北京儿童医院、北京市儿科研究所于丹副教授/姚开虎教授团队在Nature Communications上在线发表题为“PRMT3 reverses HIV-1 latency by increasing chromatin accessibility to form a TEAD4-P-TEFb-containing transcriptional hub”的研究论文,揭示了宿主PRMT3蛋白可以结合于人类免疫缺陷病毒(human immunodeficiency virus, HIV)基因启动子区,促进HIV-1转录和潜伏再激活。
于丹为首都医学科学创新中心有组织科研项目第一批聘任的青年合作研究员。

艾滋病难以根治的核心在于HIV可整合到宿主基因组进入潜伏状态,形成“潜伏病毒库”,潜伏病毒在治疗中断或宿主免疫低下时可重新激活,导致病毒繁殖及疾病进展。突破现有疗法的局限性、实现HIV潜伏库的精准调控是艾滋病治愈研究领域的关键科学问题。
本研究靶向HIV-1再激活的源头步骤——潜伏病毒沉默的DNA启动mRNA转录,通过dCas9靶向位点特异性互作蛋白分析技术,高通量筛选与HIV-1启动子区互作的宿主蛋白,发现人精氨酸甲基转移酶3(Protein arginine methyltransferase 3, PRMT3)可结合于整合在HIV-1感染者细胞基因组中的病毒基因启动子区。在细胞系模型及HIV-1感染者细胞中证明PRMT3可促进HIV-1基因转录及潜伏再激活。发现PRMT3通过增强病毒启动子区的H4R3Me2a表观修饰水平、促进染色质开放及转录复合体P-TEFb在该区域富集。进一步研究发现,PRMT3影响的染色质区含有保守的GGAAT基序(该序列是转录因子TEAD4的典型结合基序),PRMT3和TEAD4依赖该基序结合病毒启动子区,协同激活病毒基因转录。PRMT3与TEAD4、P-TEFb及HIV-1的Tat蛋白互作,在HIV-1启动子区形成转录枢纽,促进病毒的基因转录和潜伏再激活。
本研究揭示宿主蛋白PRMT3调控HIV-1基因转录及潜伏再激活的功能及机制,为开发靶向病毒再激活源头的抗艾滋病药物提供潜在新靶点。研究成果有望通过干预潜伏病毒库再激活,为攻克艾滋病治愈难题提供参考思路。
首都医科大学附属北京儿童医院硕士研究生王心玉等为第一作者,于丹副教授(主通讯作者)、姚开虎教授和香港大学周强教授为共同通讯作者。
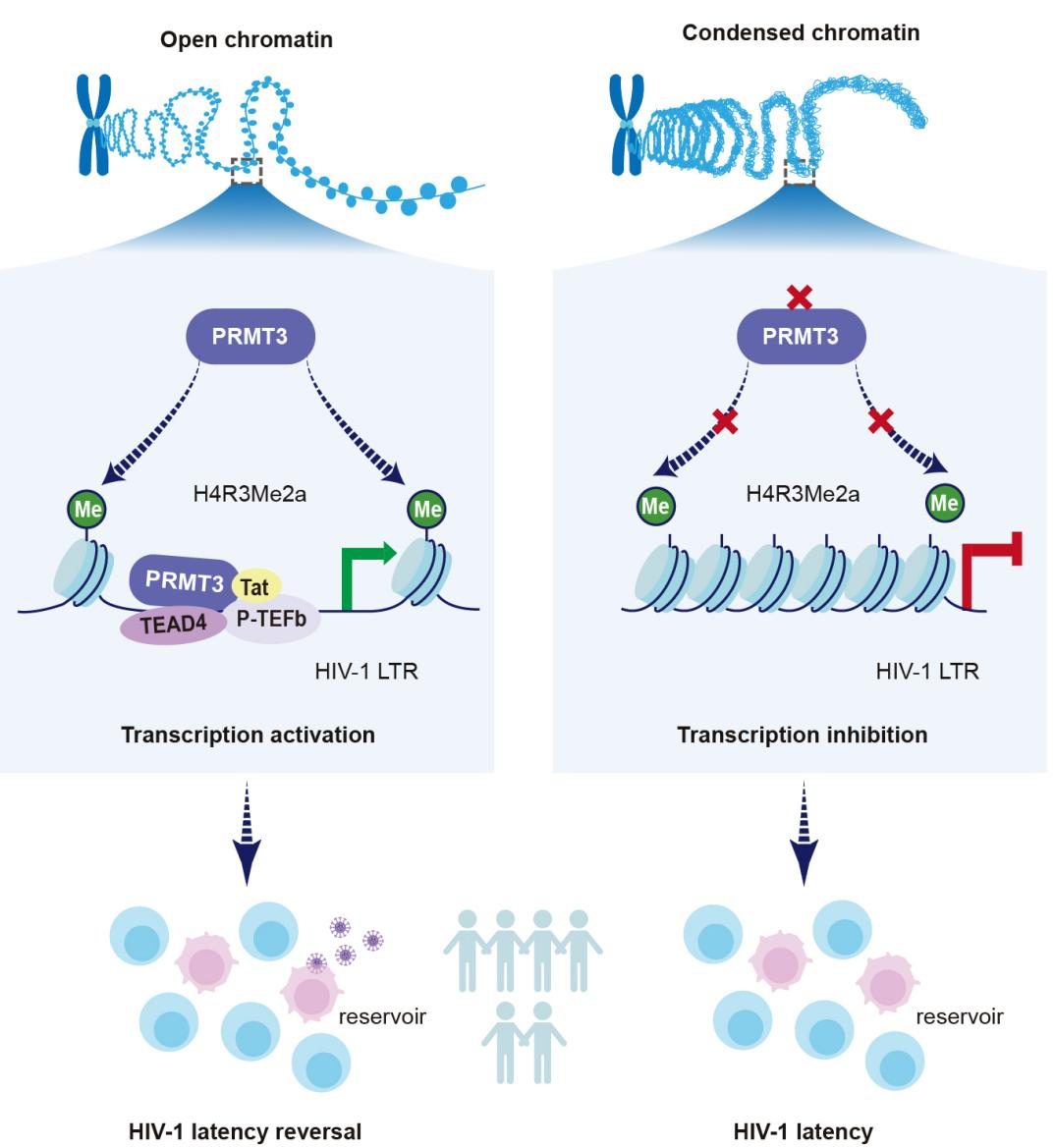
注. PRMT3调控HIV-1基因转录及潜伏再激活的假说模型图。PRMT3通过提升H4R3Me2a水平增加染色质可及性,在HIV-1启动子区形成包含TEAD4、P-TEFb和Tat蛋白的转录枢纽,从而促进病毒转录、逆转潜伏状态。
原文链接
基金支持
本研究受到了国家自然科学基金、北京市自然科学基金、首都医学科学创新中心基金、首都医科大学附属北京儿童医院基金等支持。
有组织科研项目
首都医学科学创新中心有组织科研项目以解决危害人民健康的重大疾病的痛点和难点为目标,联合首都医科大学院系和附属医院,通过构建基础-临床联合、医工、医理融合的多学科团队开展联合攻关,共同推动解决重大基础医学问题和关键技术转化应用难题。
经过前期调研、项目初审、项目复审、答辩评审、专家论证、立项支持,创新中心第一批资助有组织科研专项25个,内容涵盖了基础机制、药物开发、队列组学、医工结合等重点领域;优秀青年人才创新项目21个。聘任合作研究员21位,青年合作研究员7位,首都医学青年创新学者21位。
/青年合作研究员/

于丹
研究员、副教授、硕士生导师。国家儿童医学中心、首都医科大学附属北京儿童医院、北京市儿科研究所感染与微生物研究室副主任。致力于基因转录调控和感染性疾病发病机制及诊疗方法研究,主要学术成就:提出多个抗感染药物研发新策略,包括发现PARP1抑制剂是抗艾滋潜在新药并揭示其调控HIV转录机制、发现一氧化氮合酶抑制剂是抗超级细菌潜在新策略并揭示其介导的转录调控机制;揭示P-TEFb和DYRK1A分别主导细胞生长和分化过程的基因转录调控;建立靶向病毒基因转录过程的抗病毒药物靶点筛选新型技术平台。以第一或通讯作者在一流学术杂志发表多篇文章,授权中国发明专利5项。2021年获“北京市优秀青年人才”表彰。
项目名称:
抗病毒药物新型靶点发现及抗病毒药物研发(子课题2-揭示关键宿主因子与病毒互作调控病毒致病的分子机制)
项目简介:
项目以可导致终生持续感染的人类疱疹病毒和艾滋病毒为模式,采用具有自主知识产权的抗病毒药物靶点高通量筛选技术平台,鉴定抗病毒药物新靶点、解析病毒致病的分子机制,旨在为抗病毒新药研发提供新技术和新策略。