近日,首都医科大学、首都医学科学创新中心闫致强教授团队在Journal of Cell Biology期刊发表了题为“Mechanically gated OSCA/TMEM63 ion channels: From physiological function to structural basis”的综述文章。该综述基于团队多年来在该通道家族领域的系统性研究工作,全面梳理了OSCA/TMEM63这一从植物到人类高度保守的离子通道家族;不仅系统阐述了其在多种生理活动中的核心作用,还创新性地提出其与听觉转导关键蛋白TMC共同构成了一个结构同源的“机械门控离子通道超家族”,为理解生命体感知机械力的普遍原理提供了全新框架。
从植物到动物:OSCA/TMEM63家族的机械力感应与渗透压感应的双重功能
文章回顾了OSCA/TMEM63家族从植物到哺乳动物中的发现与研究历程。在植物中,OSCA家族成员是感知干旱、调控气孔运动与根系生长的关键渗透与机械传感器。2018年,闫致强教授团队首次发现OSCA家族的机械敏感性,与合作者解析了OSCA1.1和OSCA3.1的蛋白三维结构,该突破性成果发表于Nature Structural & Molecular Biology。2022年,闫致强团队在Nature Communications发表的研究进一步揭示,果蝇TMEM63离子通道通过调控寻水等渴觉相关行为参与水平衡调节,且人类TMEM63B蛋白能有效挽救TMEM63基因敲除果蝇的行为缺陷,证实TMEM63家族在进化过程中在调节水平衡功能的高度保守。在哺乳动物中,其同源蛋白TMEM63则扮演着更为多样的角色。TMEM63A是中枢神经系统髓鞘正常形成所必需的,其突变可导致严重的髓鞘发育不良。TMEM63B兼具机械感应与渗透感应双重功能,参与耳蜗毛细胞的渗透压感受和肺通气诱导的表面活性物质分泌。2025年,闫致强教授团队在Neuron上发表的研究成果揭示了TMEM63B作为哺乳动物感知血液高渗状态的关键离子通道,阐明了大脑穹窿下器官兴奋性神经元通过该分子感知渗透压变化、触发口渴行为的完整机制。TMEM63C则与肾脏滤过屏障功能及遗传性痉挛性截瘫密切相关(图一)。该家族成员的广泛功能和疾病关联,凸显了其在基础生理与临床医学中的重要意义。
图一:TMEM63s在不同哺乳动物细胞类型中的表达及其相关的生理功能
OSCA/TMEM63蛋白的结构解析揭示其独特的机械力门控机制
近年来,多项突破性的高分辨率冷冻电镜结构研究揭示了OSCA/TMEM63家族的蛋白结构及其独特的工作机制。OSCA/TMEM63家族蛋白有十一个跨膜区,其中TM3-7形成其孔道区。植物OSCA以二聚体形式发挥功能,而动物TMEM63多以单体存在,这种寡聚状态的差异可能是二者在机械刺激敏感性和响应速度上有所不同结构基础。与一些通过锚定-牵拉门控的机械敏感离子通道不同,OSCA/TMEM63家族主要采用膜张力门控的范式——细胞膜的张力和曲率变化直接作用于通道蛋白、诱导其构象改变,从而打开离子通道。尤为关键的是,该通道家族胞内区具有独特的双亲性螺旋结构域,如位于TM2与TM3之间的IL2H2/3结构域(图二A)。这些双亲性螺旋一侧亲水、一侧疏水,使其能够嵌于膜内表面排布并感知膜张力与曲率的变化,并将机械信号传递给参与孔道形成跨膜螺旋TM6,最终控制通道开关。此外,OSCA/TMEM63离子通透路径并非完全由蛋白质构成,而是形成了独特的“蛋白-脂质混合孔道”,脂质分子本身成为孔道结构的一部分(图二B),这一发现重新定义了我们对离子通道结构的认识。
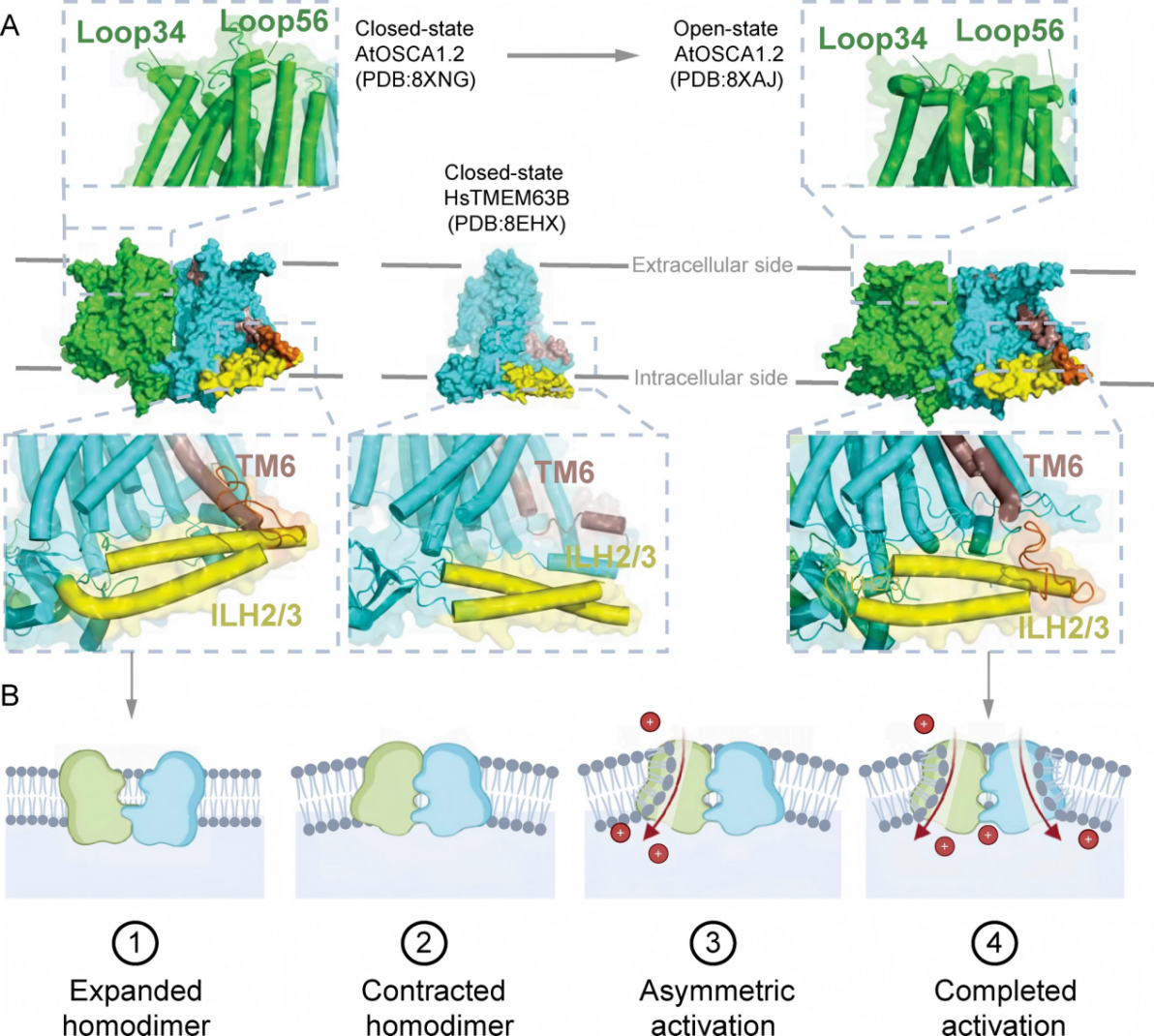
图二:OSCA/TMEM63 机械门控离子通道的门控机制和激活过程
OSCA/TMEM63在机械力转导过程中从关闭状态到激活状态的构象转变示意图。(A) OSCA/TMEM63的细胞外结构域,即TM3a - Loop34 - TM4a和TM5a - Loop56,可能感知膜厚度的变化并稳定开放构象;IL2H2 和 IL2H3 细胞内双亲性螺旋,可能作为膜张力的传感器,协调跨膜螺旋TM6的运动。(B)OSCA 通道在关闭和开放状态下同源二聚体的扩展和收缩构象,亚基的不对称激活,以及OSCA/TMEM63蛋白的开放状态构象揭示了一个蛋白质-脂质构成的孔道区。
OSCA/TMEM63在结构上与听觉机械转导通道TMC蛋白高度相似。二者拥有相似的寡聚状态、跨膜拓扑结构(10-11个跨膜区)和孔道区结构(TM3-8)。2024年,闫致强教授团队在国际知名学术期刊Neuron上发表的研究成功突破了哺乳动物TMC1和TMC2 (TMC1/2)蛋白在细胞系内异源表达无法定位在细胞膜上的难题,证明了人类TMC1/2是机械力门控离子通道,提供了其在毛细胞上作为听觉受体的决定性证据,揭开了感觉神经生物学领域内长期悬而未决的谜团。根据OSCA/TMEM63家族蛋白和TMC蛋白的结构的相似性和机械门控的机制,文章正式提出它们属于同一个机械门控离子通道超家族(图三)。
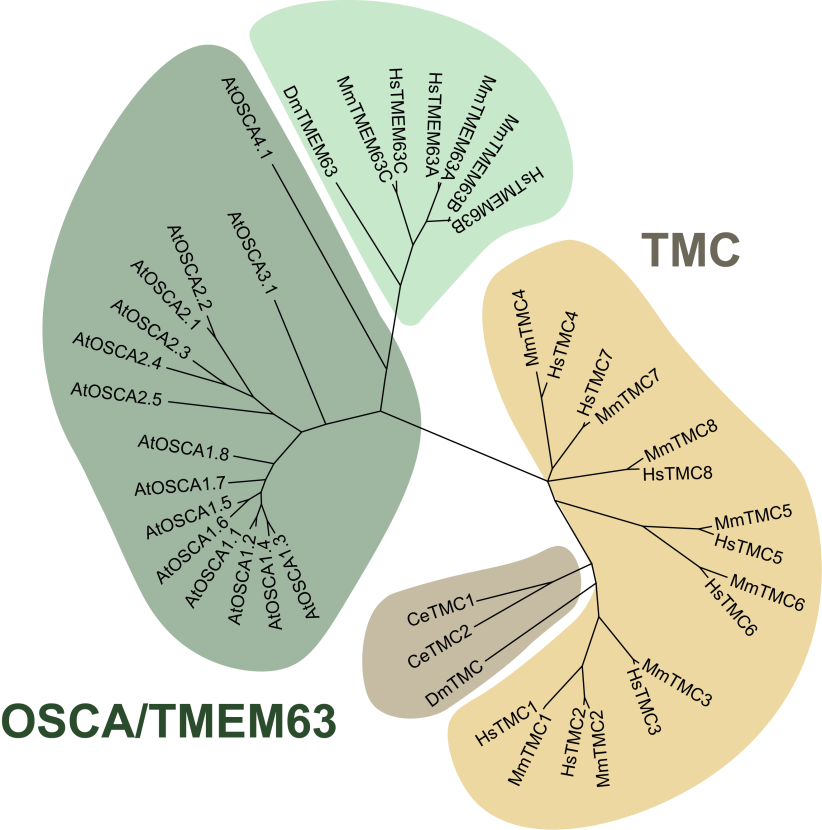
图三:TMC-TMEM63为最大的哺乳动物机械敏感超家族
尽管TMEM63蛋白在哺乳动物中功能重要,目前针对TMEM63家族的靶向治疗工具仍属空白。TMEM63A/B/C蛋白突变可导致从神经系统发育障碍、癫痫、水平衡失调到肾脏疾病等多种病理状况。未来通过解析其处于开放状态的三维结构、开发特异性调节药物或基因治疗策略,有望为相关疾病带来新的治疗希望。例如,调节TMEM63A的活性可能促进髓鞘再生,干预TMEM63B可能改善体内水平衡异常或胰岛素分泌。
该综述由首都医科大学、首都医学科学创新中心闫致强教授领衔,香港科技大学博士生邓锶绮为第一作者,香港科技大学博士生邱沁灵为合作作者,香港科技大学党尚宇教授共同通讯作者。该工作得到科技部科技创新2030重大项目、国家重点研发计划、国家自然科学基金、深圳市医学研究专项等基金和深圳湾实验室的支持。
原文链接:https://doi.org/10.1083/jcb.202507014
获得复旦大学学士学位、中科院神经科学研究所以及北京生命科学研究所、中科院生物物理研究所博士学位,在加州大学旧金山分校及霍华德·休斯医学研究所完成博士后研究。曾任复旦大学生命科学学院研究员,深圳湾实验室分子生理学研究所资深研究员、副所长。现任首都医学科学创新中心资深研究员、医学生理学研究所所长,首都医科大学基础医学院教授、院长。
闫致强实验室长期从事感觉神经生物学的研究,综合运用分子生物学、蛋白相互作用和结构分析、电生理记录、神经回路的光遗传、化学遗传和成像等技术手段,结合药物筛选和基因编辑小鼠模型,进行听觉、触觉、渴觉等感觉受体的鉴定和工作机制研究,感觉系统神经回路,以及感觉系统疾病的机理和治疗,并探索这些感觉受体在其他重要生理功能中的作用。



