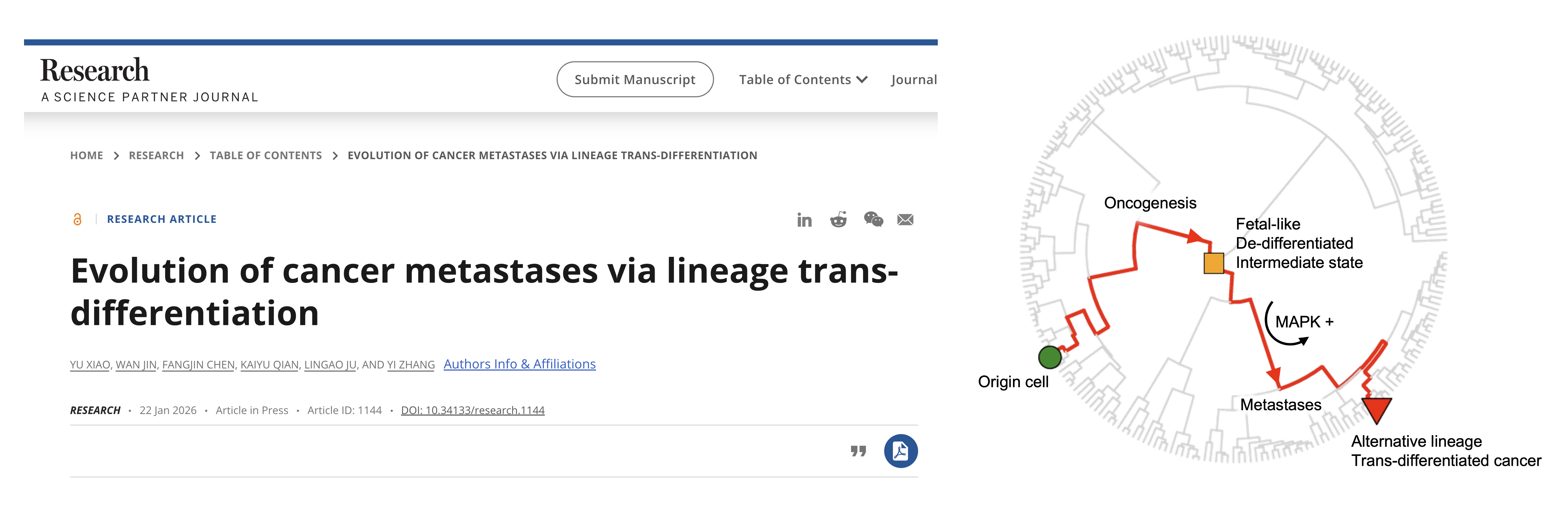
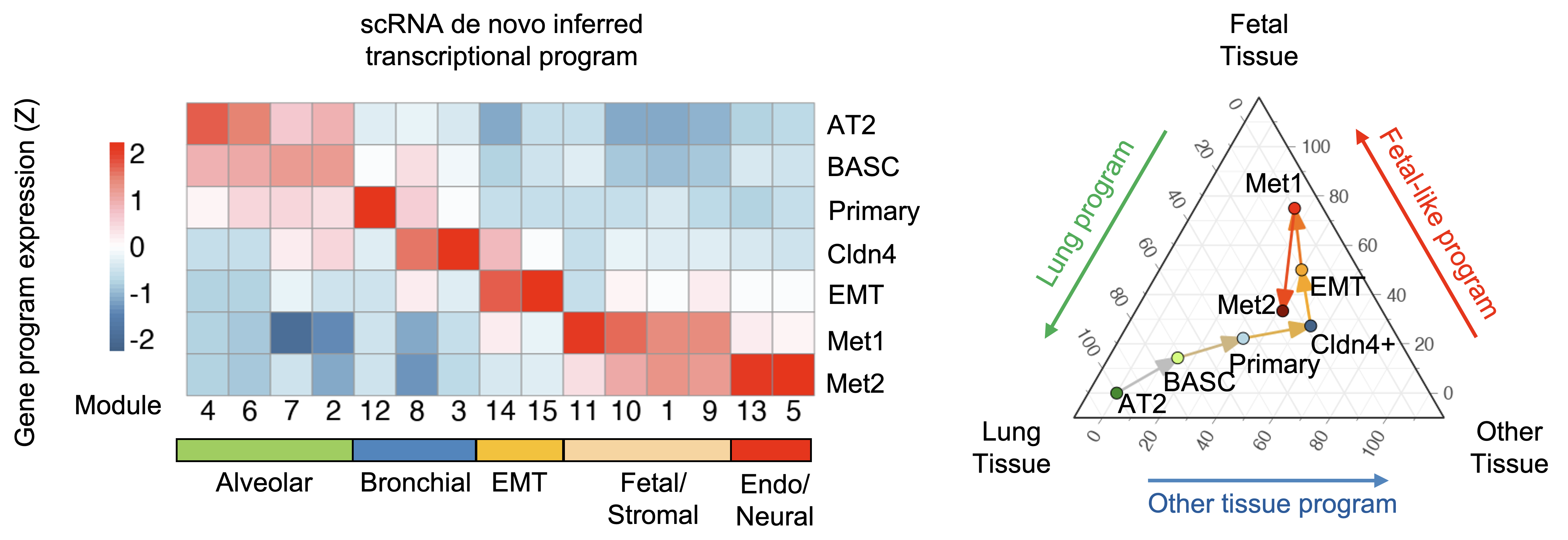
图1: 小鼠Kras-Trp53肺腺癌模型中的肿瘤演化伴随着其基因表达谱水平上的转分化。
体外移植瘤模型单细胞数据分析和临床配对样本DNA甲基化分析表明,转分化现象发生早于肿瘤转移。进一步的单细胞谱系示踪分析提示,转分化发生在原发灶EMT后阶段。通过单细胞多组学分析,研究团队发现,在高可塑性状态阶段,其它谱系主控转录因子已经表达,但并未产生活跃作用。直到EMT阶段,由于全基因组染色质开放性增加,这些转录因子得以结合到基因组上,驱动其下游基因表达程序,完成谱系转分化诱导。这些表达替代谱系特征的细胞并非源自不同的起源细胞,而是在演化过程中逐步“失去方向”。从演化角度看,这并不是简单的表型噪声,而是谱系约束松动后的必然结果。肿瘤细胞不再被严格限制在原有的分化轨迹中,而是获得了探索其他命运路径的能力。有趣的是,种群数量分析表明,在EMT阶段出现了一个明确的群体瓶颈,暗示这些探索不同路径的转分化细胞最终只有一小部分通过层层选择,成功演化为远端种植的转移克隆。

图2: 小鼠Kras-Trp53肺腺癌演化过程中,替代谱系主控转录因子在高可塑性阶段即开始预表达。EMT事件诱导全基因组开放,激活表观可塑性,最终生成多样异质的转分化肿瘤细胞群体。极高的表型多样性使得肿瘤群体具备了适应自然选择的潜力,能够穿过造成种群瓶颈的多种选择,最终形成转移定植。
进一步地,研究团队开发了DNA甲基化谱系转分化指数(DNAmDev)指标,利用来自11种不同人类肿瘤(肺腺癌、乳腺癌、前列腺癌、胃癌、结直肠癌、透明细胞肾癌、肝癌、头颈癌、脑膜瘤、胰腺神经内分泌肿瘤和葡萄膜黑色素瘤)的临床样本,在单细胞转录组、表观遗传组等多个维度上验证了转分化现象存在于几乎所有的实体瘤类型,且其水平在转移灶中显著上升。在近万例 TCGA 肿瘤样本中,转分化水平可预测更高的组织病理学分级、更强的转移潜能及更短的患者生存期。在多因素分析中,该指数可独立预测肿瘤进展和总生存期,显著优于传统的胎儿样标志物(mDNAsi)。
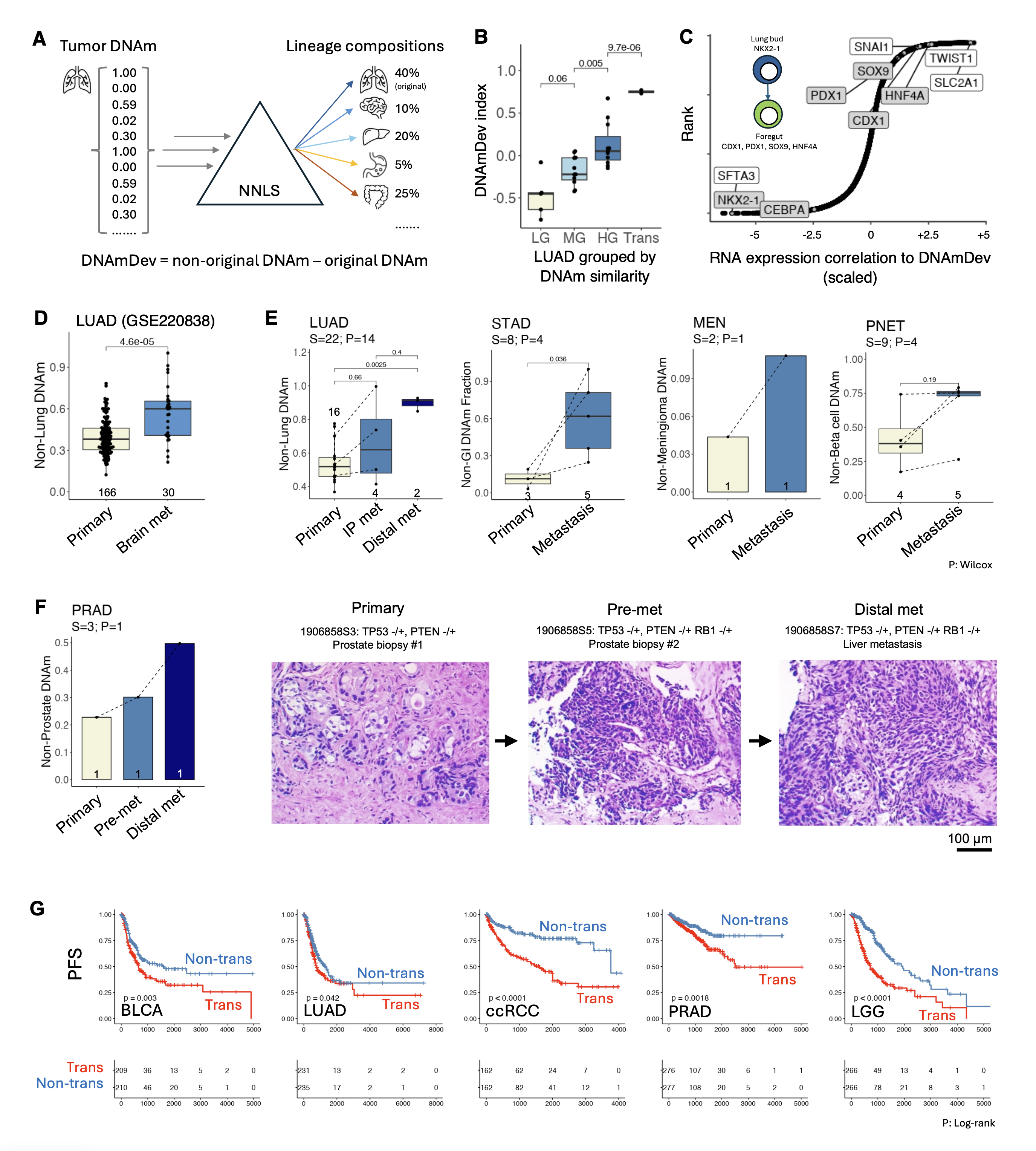
图3: 人类肿瘤样本中DNA甲基化转分化指数(DNAmDev)显著相关于替代谱系转录因子RNA表达。与配对原发灶比较,转移灶具有显著更高的甲基化转分化指数。在肿瘤原发位置,预转移的肿瘤克隆即已发生转分化水平的提升。在公开数据库泛癌种分析中,高甲基化转分化指数提示显著缩短的无进展生存期。
通过对肺癌患者临床样本进行遗传分析,结合单细胞水平数据,研究团队发现,MAPK通路的过度激活通过表观遗传重编程上调其他谱系主控转录因子的表达,诱导转分化发生。更值得注意的是,这一状态在药物干预下表现出一定的可逆性。在患者体内,靶向MAPK 抑制可逆转发育谱系转分化,而在肿瘤获得耐药并发生疾病进展时,转分化信号再次增强。这一观察提示了ADAURA、ALINA、COMBI-AD、NEfERT-T、NALA等临床试验中术后辅助TKI治疗预防转移的分子机制。在体外模型中,沉默MAPK下游的GATA3、ETV6等其他谱系主控转录因子显著地抑制肺癌细胞侵袭和迁移,证明发育谱系转分化是肿瘤转移的重要驱动因素。

图4: 人类肿瘤样本中MAPK抑制可部分逆转谱系转分化。在转分化细胞中,替代谱系主控转录因子的表达受MAPK活性调控。敲降MAPK下游的替代谱系主控转录因子显著抑制肿瘤侵袭。
整体来看,这项研究提供了一种理解肿瘤转移的演化视角。转移不再被视为由某个单一表型或分子突变所触发的事件,而是一个伴随着表观遗传失稳、逐步放松谱系约束的连续过程。在这一过程中,胎儿样状态和 EMT 实际上是一个过渡窗口。表观遗传重编程造成的转分化,是瘤内异质性的一个重要组成部分。看似确定性的原发-转移演化轨迹,与随机的转分化事件,在群体统计视角上得到了统一。而转移灶肿瘤表现出的“关键表型跃迁”,实际上是多种路径探索的跨发育谱系边界转分化细胞群体通过免疫控制和远端器官生态位的层层选择后,最终成功突出重围的一小群细胞的表型。
本研究首次提出“转分化是泛肿瘤转移的核心驱动力和标志性特征”这一理论,系统阐明了表观遗传重编程驱动转移演化的详细分子机制,填补了“转移灶与原发灶基因型相似但表型差异显著”这一长期悬而未决的理论空白,解释了ALK融合、EGFR扩增等强MAPK突变肿瘤易转移的临床观察,提供了一种评估转移风险的新型诊断工具,同时还为开发预防肿瘤转移的创新疗法提供了坚实的科学基础。
本研究依托首都医学科学创新中心、武汉大学/湖北省重点实验室及北京大学-清华大学生命联合中心超算平台开展工作。张翼博士为该论文通讯作者,鞠林高博士为共同通讯作者,肖宇博士、金婉博士为该论文共同第一作者。陈芳进博士及钱开宇博士为本研究作出了重要贡献。该研究得到了首都医学科学创新中心、首都医科大学、教育部、北京大学、国家自然科学基金委、武汉大学中南医院等多方支持。研究中开发的scLineageFidelity算法全部实现代码及用户手册已经开源发布(https://github.com/MagpiePKU/scLineageFidelity)。
原文链接:https://spj.science.org/doi/10.34133/research.1144
作者介绍
张翼
获得北京大学学士及博士学位。现任首都医学科学创新中心青年研究员。
张翼实验室的主要研究兴趣是从静态、离散的样本中准确重建出动态、连续的生物学过程的历史轨迹,以便更好地理解发育、衰老、疾病发生发展的分子机制,为重大疾病的诊断和治疗提供理论依据与技术支撑。
张翼实验室长期招聘对表观遗传学与疾病、衰老交叉研究方向感兴趣的科研助理、博士研究生、博士后。欢迎具有强烈的科研兴趣、良好的相关研究经历及高质量学术论文发表纪录的研究人员应聘(邮件:zhangyi@cimrbj.ac.cn)。实验室主页:https://www.zhangyilab.com/