撰文 | 刘嘉妮
审核 | Yuval Rinkevich 曹英西
近日,首都医学科学创新中心特聘研究员、再生生物学与医学研究所所长、首都医科大学讲席教授Yuval Rinkevich教授团队在Nature Communications上在线发表题为“A mesothelial differentiation gateway drives fibrosis”的研究论文。研究发现了覆盖在人体内脏表面的一层细胞(间皮细胞)在器官纤维化过程中扮演了关键角色,并找到了控制它们行为的关键基因。通过调控这些基因,成功在小鼠模型中阻止了肺部纤维化的发展,这为未来治疗肺纤维化等疾病带来了新希望。

原文链接:https://www.nature.com/articles/s41467-025-63990-2
器官纤维化是许多慢性疾病(如特发性肺纤维化、肝硬化、心力衰竭)的共同终末途径,目前缺乏有效的治疗方法。传统的观点认为纤维化主要由器官内部的成纤维细胞驱动。然而,覆盖在器官表面的间皮细胞在纤维化中究竟扮演“旁观者”还是“主动参与者”的角色?如果是参与者,它们如何被激活、如何变化、以及如何驱动疾病进程?这些核心问题此前一直未被系统性地解答。
回答上述问题会面临多重挑战:间皮细胞并非一个均一的群体,但在健康和疾病状态下究竟存在哪些功能不同的亚型,缺乏全景式的描绘。 纤维化是一个动态演变的过程,这很难捕捉间皮细胞在疾病不同阶段的动态变化轨迹。 在小鼠模型中发现的机制是否适用于人类?不同器官(如肺、肝、心)的间皮细胞在纤维化中是否遵循共同的规律?这需要大规模、系统性的比较分析。
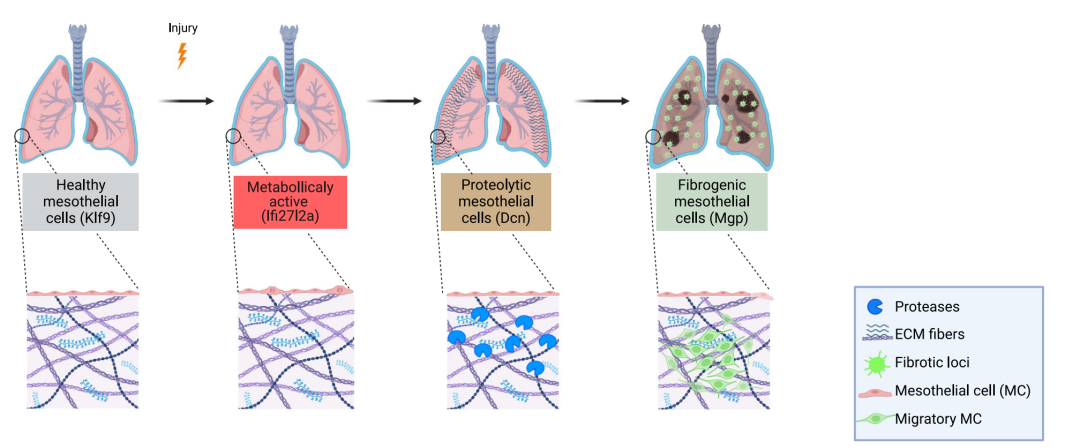
本研究绘制首张跨物种间皮细胞“全景地图”: 研究团队整合了小鼠和人类共数十个器官的单细胞RNA测序数据,构建了全球首个全面的“间皮细胞图谱”。这张地图清晰地揭示了,在健康状态下,间皮细胞就存在具有不同功能倾向的亚群;而在疾病状态下,它们会进入全新的、高度特化的激活状态。揭示纤维化的“四步舞曲”: 通过高时间分辨率分析小鼠肺纤维化模型,研究团队首次发现间皮细胞并非简单地被“激活”,而是遵循一个清晰的四阶段分化路径:首先进入代谢活跃状态,随后分化为具有降解细胞外基质能力的蛋白水解状态,进而转变为招募免疫细胞的免疫调节状态,最终成熟为大量产生胶原蛋白的纤维生成状态。同时作者发现调控每一步的“关键开关”: 研究成功鉴定了控制每一步状态转换的核心基因。例如,Ifi27l2a和Crip1是启动“代谢活跃状态”的开关;Dcn和Plac8是导向“蛋白水解状态”的开关;而Mgp和Sparc则是驱动“纤维生成状态”的开关。实现“定向干预”,验证治疗潜力: 这是本研究最具转化价值的部分。团队开发了一种新型病毒载体,能精准地将基因递送到小鼠肺部间皮细胞。令人振奋的是,提前将间皮细胞“锁定”在代谢活跃状态(通过过表达Ifi27l2a),能有效阻止细胞向有害状态分化,从而显著减轻甚至预防肺纤维化的发生。相反,强制使其进入蛋白水解或纤维生成状态,则会加速病情恶化。这直接证明了操控间皮细胞状态足以决定纤维化的走向。
本研究彻底改变了我们对纤维化发病机制的理解,将间皮细胞从边缘角色提升为疾病进程的“核心调控者”。所提供的细胞图谱和分化路径为整个纤维化研究领域提供了宝贵的资源和新的理论框架。
研究发现的多个关键基因(尤其是具有保护作用的Ifi27l2a)为开发全新的抗纤维化药物提供了前所未有的靶点。未来,科学家可以致力于寻找能够模拟Ifi27l2a效应的药物,通过干预器官表面的这层细胞,从“源头”上阻止纤维化的发生,这为治疗目前几乎无药可医的纤维化疾病开辟了全新的方向。
本研究颠覆了传统认知,首次揭示覆盖器官表面的间皮细胞是纤维化的关键“指挥中心”。通过构建跨物种细胞图谱,团队发现了间皮细胞驱动纤维化的动态分化路径,并鉴定出可干预该过程的关键基因。这为肺、肝、心等多器官纤维化疾病的早期诊断、精准靶向治疗及新药研发开辟了全新途径,实现了从基础研究到临床应用的重大概念突破。
困难与挑战
这项研究是一项规模宏大的系统性工程,从最初的构思、数据积累到最终的论文发表,总共耗时约5至6年。合作单位包括德国赫尔姆霍兹慕尼黑中心、慕尼黑大学、首都医科大学、首都医学科学创新中心等,跨越多国多学科团队。
研究过程中面临的最大挑战,是如何 “在活体动物模型中精确地、特异性地干预位于器官最外表面的间皮细胞,并令人信服地证明其细胞状态的变化直接驱动或抑制了深部组织的纤维化病变”。 传统的转基因或基因敲除小鼠模型,其影响往往是全身性的或器官广谱的,无法特异性地只靶向肺、肝或心脏表面的薄薄一层间皮细胞。这就无法回答“间皮细胞的变化究竟是纤维化的原因还是结果”这个核心问题。为了突破这一瓶颈,研究团队花费了大量精力,设计并优化了一种新型的腺相关病毒(AAV)载体。他们在病毒外壳上引入了RGD肽段,使其能高效结合并感染间皮细胞。更重要的是,他们建立了一种微创手术技术,能够将病毒精确地注射到小鼠的胸膜腔(肺表面)或腹膜腔(肝、肠表面),从而实现对器官表面间皮细胞的高效、特异基因操控。这一技术的成功开发,是本项目能否取得突破的关键。
亮点
本研究提出了一个颠覆性的“由外向内”的纤维化新模型。纤维化过程始于器官表面的间皮细胞。这些细胞被激活后,先降解表面的原有基质,然后将这些降解产物连同新生的纤维化信号一起“推送”到器官内部,从而启动和放大内部的纤维化反应。这相当于为我们理解纤维化打开了一扇全新的“大门”。发现了一个潜在的“纤维化刹车器”——代谢状态。人为地将间皮细胞“锁定”在疾病早期的“代谢活跃状态”,反而能阻止其向更恶性的状态发展,从而预防纤维化。
后续研究计划
未来将进一步验证关键基因在人类样本中的表达与功能,开发针对crip1、Ifi27l2a等基因的干预策略,与此同时探究crip1、ifi27l2a等基因对肺纤维化影响的机制,并探索其在其他纤维化疾病(如肝、心纤维化)中的应用。