近日,首都医科大学、首都医学科学创新中心闫致强教授团队在Current Opinion in Neurobiology期刊发表了题为“TMC1 and TMC2 function as the mechano-electrical transduction ion channel in hearing”的综述文章。该综述系统性总结了机械力门控离子通道TMC1/2作为听觉受体的关键证据,并深入探讨了其门控机制及未来研究方向。

听觉是人类感知外界的重要途径。当声波传入外耳后,会以机械振动的形式传递至内耳。耳蜗内的柯蒂氏器是听觉机械-电转导的起始部位,包含超过16000个机械感受毛细胞,其顶端阶梯状的静纤毛通过顶端链接(tip-link)构成毛束。当声音的振动传至基底膜,毛细胞顶部的静纤毛产生位移,施加机械力于tip-link上从而激活位于静纤毛顶端的机械电转导(MET)离子通道(图一)。这些毛细胞的机械敏感性极高,基底膜纳米级的振动就可以引起听觉。然而,位于静纤毛顶端负责机械力转导的听觉受体的身份在过往四十年间悬而未决。该综述回顾了过往的研究,从耳聋表型关联、静纤毛顶端特异性定位、对毛细胞机械转导的必要性及机械力门控离子通道特性四个方面,总结机械力门控离子通道TMC1/2是人们长期以来所寻找的听觉受体分子。
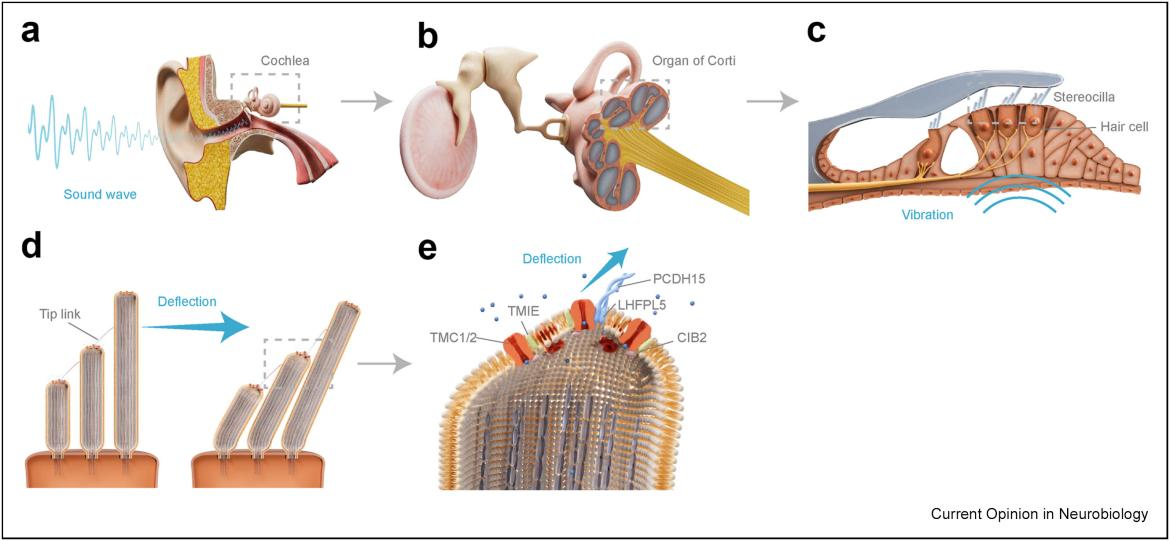
图一. 耳蜗毛细胞中的机械电转导过程
(a)当声波传入外耳后,会以机械振动的形式传递至内耳。(b)在耳蜗内,柯蒂氏器是听觉机械电转导的产生部位。(c)耳蜗内有三排外毛细胞和一排内毛细胞,这些毛细胞对机械刺激具有高敏感性。(d)毛细胞顶端阶梯状排列的静纤毛通过顶端链接(tip-link)构成了毛束,静纤毛的偏转会施加机械力于tip-link上,从而激活位于静纤毛顶端的机械电转导(MET)离子通道。(e)MET复合体包括TMC1/2(橙色)及其辅助亚基CIB2(粉色)和TMIE(绿色)。当对tip-link施加偏转力时,tip-link通过蛋白相互作用直接激活MET通道(锚定牵拉模型);并将力传递至膜上,通过膜张力激活未与tip-link相连的MET通道(膜张力门控模型)。
2002年,TMC1(transmembrane channel like 1)基因的突变被发现可以导致人类(DFNA36和DFNB7/B11)及小鼠耳聋 [1,2]。2011年研究发现TMC1/2双敲除小鼠的毛细胞完全丧失MET电流,证实二者在听觉的机械电转导中不可或缺 [3]。TMC1/2定位于毛细胞静纤毛顶端,即听觉机械转导发生的位置 [4]。但这些只是一个分子作为听觉受体的必要条件,不足以证明它们是听觉受体,众多耳聋相关的基因也满足这些条件。作为转导机械力的分子,机械力敏感性是听觉受体最关键的特征,因此,验证人类TMC1/2蛋白具有机械力门控离子通道功能,才是证实其作为听觉受体的关键性证据。然而培养细胞中异源表达的TMC1/2不定位在细胞膜,难以记录电流来证明其为机械力门控离子通道。2020年,闫致强团队突破这一技术瓶颈,将绿海龟TMC1和虎皮鹦鹉TMC2纯化蛋白重构到脂质体中并记录到了机械力门控电流,首次证实脊椎动物TMC1/2具有机械门控离子通道活性 [5];2025年,闫致强团队进一步通过全基因组CRISPRi筛选,使异源表达的人类TMC1/2在HEK293T细胞膜上定位,确证人类TMC1/2为机械门控离子通道,支持TMC1/2作为哺乳动物听觉受体 [6]。(图二)
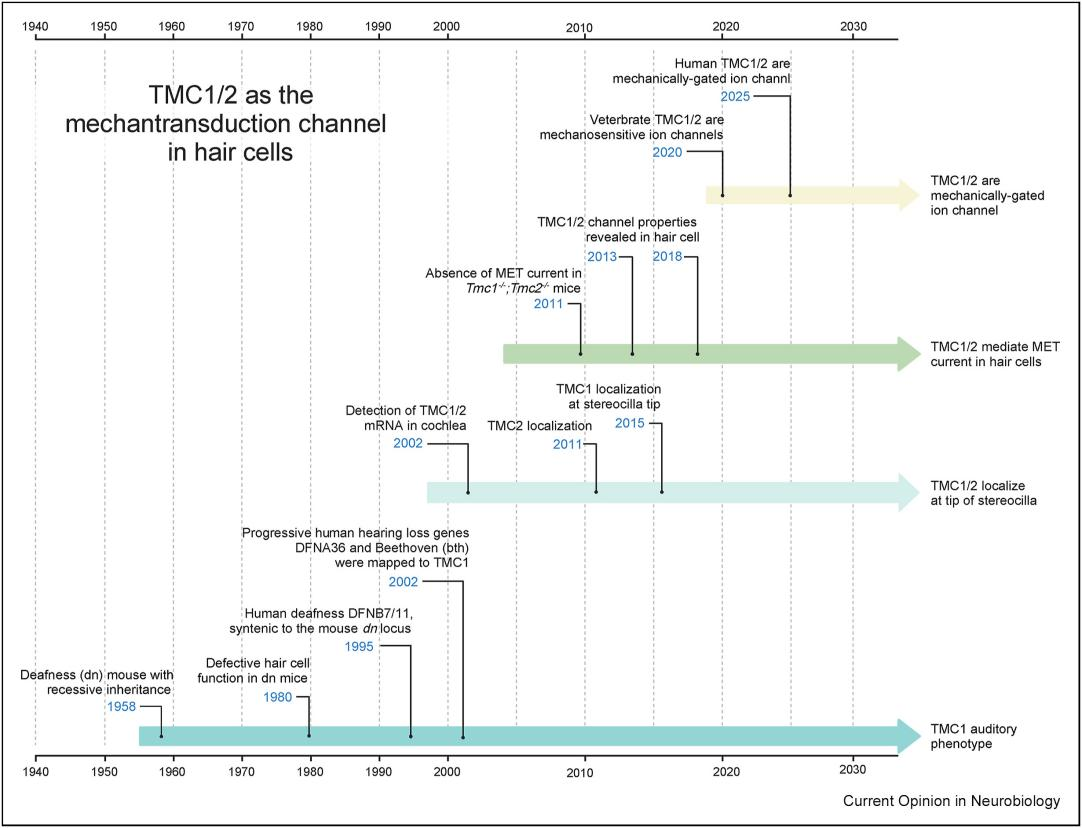
图二. 从耳聋表型关联、静纤毛顶端特异性定位、对毛细胞机械转导的必要性及机械力门控离子通道特性四个方面的证据支持TMC1/2是毛细胞上负责听觉中机械电转导的离子通道(1958年到2025年间TMC1/2有关的代表性发现)
锁定耳蜗毛细胞中的听觉受体分子后,揭示TMC1/2如何在生理环境中将细微的机械振动转化为电信号是领域内亟待破解的下一个核心问题。在毛细胞中,tip-link将机械力传递给静纤毛顶端MET通道。过往研究发现静纤毛顶端可被激活的MET通道的数量多于tip-link的数量 [7,8],表明TMC1/2可能通过tip-link拉伸时产生的膜张力被激活,而无需直接与tip-link发生物理接触。基于此,闫致强团队提出了一个TMC1/2双门控机制协同作用的模型,解释了毛细胞如何响应不同强度的声音刺激:在机械刺激的初步阶段,tip-link通过PCDH15/LHFPL5与TMC1/2蛋白的相互作用,在锚定牵拉模型(tether-gating)的作用下打开TMC1/2通道;在进一步增强的机械刺激下,tip-link通过牵拉静纤毛顶端引起的膜张力激活未与tip-link直接连接的TMC1/2(膜张力门控模型,membrane-tension gating),这种分级响应机制使毛细胞可感知从0至100分贝不同声强(图三,视频一)。TMC1/2膜张力门控模型提示TMC1/2在没有PCDH15和LHFPL5的存在时也可以被机械力激活,与异源表达的TMC1/2可以产生机械力门控电流的研究结果相符 [5,6]。人类TMC1在脂质膜环境下的分子模拟揭示膜张力门控机制分两步激活通道:初始张力使跨膜区TM4和TM6之间的空间变大,重新定向的脂质头部亲水基团暂时阻断孔道;在更高的膜张力下,跨膜区TM4和TM6进一步分离,阻塞孔道的脂质横向移动,形成一个由蛋白和脂质组成的孔道区使离子通过 [9](图四,视频二),该TMC1蛋白-脂质孔道模型与结构相似的超家族成员OSCA通道的开放态相似 [10]。未来研究需进一步探索TMC1/2的门控机制,以更深入地了解听觉机械-电转导的分子基础:为了探索毛细胞中tip-link如何将力作用于TMC1/2,后续研究需解析TMC1/2与tip-link复合体的高分辨率结构,明确力传递的分子界面;为了探索TMC1/2膜张力门控机制,需解析TMC1/2的离子孔道区和感应膜张力的机械敏感结构域。
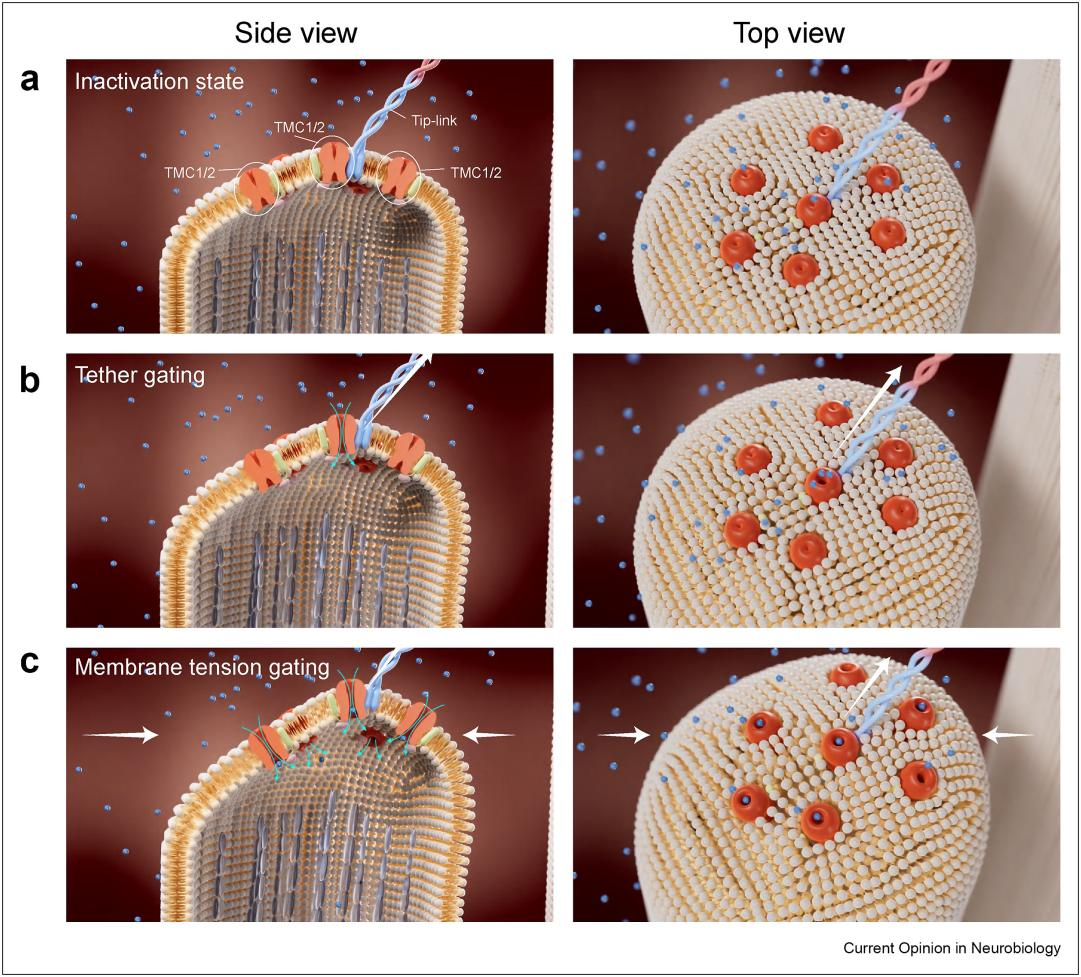
图三. 毛细胞静纤毛顶端TMC1/2双门控机制模型
在耳蜗毛细胞静纤毛顶端的机械转导过程可能存在多种门控机制,这些机制协同作用使得 TMC1/2对机械力高敏感响应。(a-b)在被机械力激活的初始阶段,与tip-link相连的TMC1/2通过蛋白相互作用被打开(锚定牵拉模型),使其对细微的机械刺激做出反应。(c)随着tip-link传递的机械刺激的增强,膜张力使未与tip-link连接的TMC1/2逐渐被激活(膜张力门控模型)。
视频一:
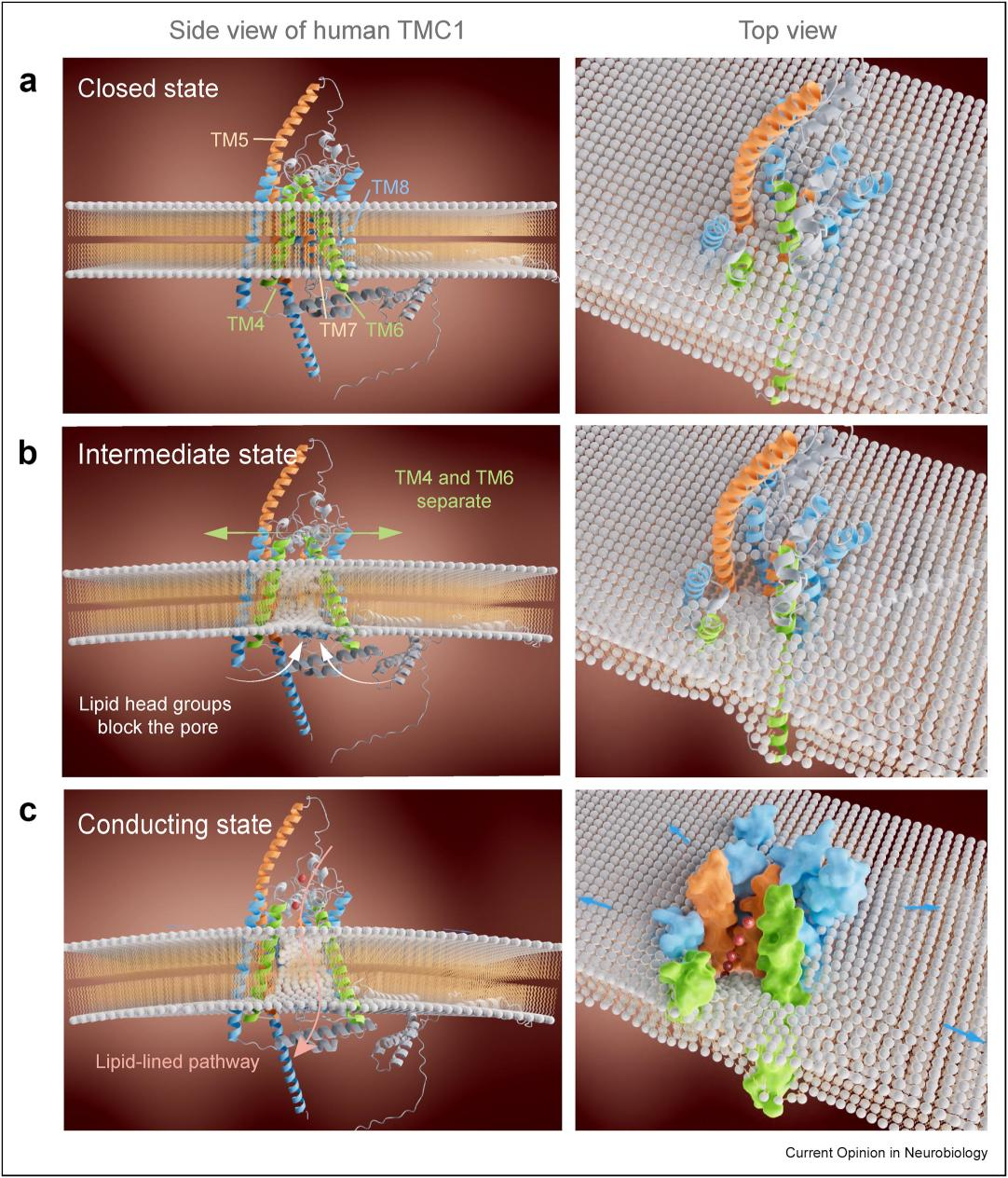
图四. TMC1膜张力门控模型
基于人类 TMC1的分子动力学模拟和结构相似的超家族成员OSCA 通道的开放态结构提出的TMC1膜张力门控模型,该模型展示了TMC1在被膜张力打开过程中的三种不同状态:(a)通道关闭状态;(b)中间状态:当初始膜张力作用于TMC1时,跨膜区TM4和TM6被拉开,脂质分子头部亲水基团会改变方向堵塞TM4和TM6之间空间,阻止离子通过。(c)开放状态:当作用于TMC1的膜张力增加时,形成一个由蛋白质和脂质组成的孔道区使离子通过。
视频二:
基金支持
科技部科技创新2030重大项目、国家重点研发计划项目、国家自然科学基金、深圳市优秀科技创新人才培养项目和深圳市医学研究专项。
原文链接
https://www.sciencedirect.com/science/article/pii/S0959438825000571
参考文献
1. Kurima, K., Peters, L. M., Yang, Y., Riazuddin, S., Ahmed, Z. M., Naz, S., Arnaud, D., Drury, S., Mo, J., Makishima, T., et al. (2002). Dominant and recessive deafness caused by mutations of a novel gene, TMC1, required for cochlear hair-cell function. Nat. Genet. 30, 277-284. https://doi.org/10.1038/ng842
2. Vreugde, S., Ereven, A., Kros, C. J., Marcotti, W., Fuchs, H., Kurima, K., Wilcox, E. R., Friedman, T. B., Griffith, A. J., Balling, R., et al. (2002). Beethoven, a mouse model for dominant, progressive hearing loss DFNA36. Nat. Genet. 30, 257-258. https://doi.org/10.1038/ng848
3. Kawashima, Y., Géléoc, G. S. G., Kurima, K., Labay, V., Lelli, A., Asai, Y., Makishima, T., Wu, D. K., Della Santina, C. C., Holt, J. R., et al. (2011). Mechanotransduction in mouse inner ear hair cells requires transmembrane channel–like genes. J. Clin. Invest. 121, 4796-4809. https://doi.org/10.1172/jci60405
4. Kurima, K., Ebrahim, S., Pan, B. F., Sedlacek, M., Sengupta, P., Millis, B. A., Cui, R. J., Nakanishi, H., Fujikawa, T., Kawashima, Y., et al. (2015). TMC1 and TMC2 localize at the site of mechanotransduction in mammalian inner ear hair cell stereocilia. Cell Rep 12, 1606-1617. https://doi.org/10.1016/j.celrep.2015.07.058
5. Jia, Y., Zhao, Y., Kusakizako, T., Wang, Y., Pan, C., Zhang, Y., Nureki, O., Hattori, M., and Yan, Z. (2020). TMC1 and TMC2 proteins are pore-forming subunits of mechanosensitive ion channels. Neuron 105, 310-321. https://doi.org/10.1016/j.neuron.2019.10.017
6. Fu, S., Pan, X., Lu, M., Dong, J., and Yan, Z. (2025). Human TMC1 and TMC2 are mechanically gated ion channels. Neuron 113, 411-425. https://doi.org/10.1016/j.neuron.2024.11.009
7. Beurg, M., Cui, R., Goldring, A. C., Ebrahim, S., Fettiplace, R., and Kachar, B. (2018). Variable number of TMC1-dependent mechanotransducer channels underlie tonotopic conductance gradients in the cochlea. Nat. Commun. 9, 2185. https://doi.org/10.1038/s41467-018-04589-8
8. Fettiplace, R., Furness, D. N., and Beurg, M. (2022). The conductance and organization of the TMC1-containing mechanotransducer channel complex in auditory hair cells. PNAS 119, e2210849119. https://doi.org/10.1073/pnas.2210849119
9. Walujkar, S., Lotthammer, J. M., Nisler, C. R., Sudar, J. C., Ballesteros, A., and Sotomayor, M. (2021). In silico electrophysiology of inner-ear mechanotransduction channel TMC1 models. bioRxiv 2021.2009.2017.460860. https://doi.org/10.1101/2021.09.17.460860
10. Han, Y., Zhou, Z., Jin, R., Dai, F., Ge, Y., Ju, X., Ma, X., He, S., Yuan, L., Wang, Y., et al. (2024). Mechanical activation opens a lipid-lined pore in OSCA ion channels. Nature 628, 910-918. https://doi.org/10.1038/s41586-024-07256-9
闫致强
获得复旦大学学士学位、中科院神经科学研究所以及北京生命科学研究所、中科院生物物理研究所博士学位,在加州大学旧金山分校及霍华德·休斯医学研究所完成博士后研究。现任首都医科大学基础医学院教授、院长,首都医学科学创新中心资深研究员、医学生理学研究所所长。
实验室长期从事感觉神经生物学的研究,综合运用分子生物学、蛋白相互作用和结构分析、电生理记录、神经回路的光遗传、化学遗传和成像等技术手段,结合药物筛选和基因编辑小鼠模型,进行听觉、触觉、渴觉等感觉受体的鉴定和工作机制研究,感觉系统神经回路,以及感觉系统疾病的机理和治疗,并探索这些感觉受体在其他重要生理功能中的作用。
闫致强实验室长期招聘博士后、副研究员/助理研究员、技术员等岗位,详情请点击查看: