撰文 | 贾富钏(2024级博士研究生)
审核 | 梅 林
研究背景
急性髓系白血病(AML, Acute Myeloid Leukemia)是一种血液系统的恶性肿瘤,主要特征是骨髓中异常的、未成熟的髓系细胞(即白血病细胞)大量增殖,这些细胞不能正常分化为功能性的成熟血细胞。根据美国国家癌症研究所,成人AML患者的5年相对生存率为约30.5%,预后较差。现有的研究表明,AML的发生与特定基因突变和某些信号通路的异常密切相关。例如,IDH1/2突变可作为早期驱动因素促进AML发生。此外,Wnt信号通路和MYC相关通路的异常能够促进白血病细胞增殖和存活等。
近年来已发现mRNA上的化学修饰在正常生命活动调控中扮演着重要角色,当其失调则可能导致肿瘤、神经系统疾病等。m6A修饰(N6-methyladenosine modification)是mRNA内部丰度最高的化学修饰。m6A在AML中的作用日益受到关注,如m6A甲基转移酶METTL3和去甲基化酶FTO均被报道参与AML的发生过程。此外,多种m6A阅读蛋白(例如YTHDF2和IGFBPs)也被发现与白血病相关。这暗示着m6A调控因子可能能作为AML治疗的潜在靶点。
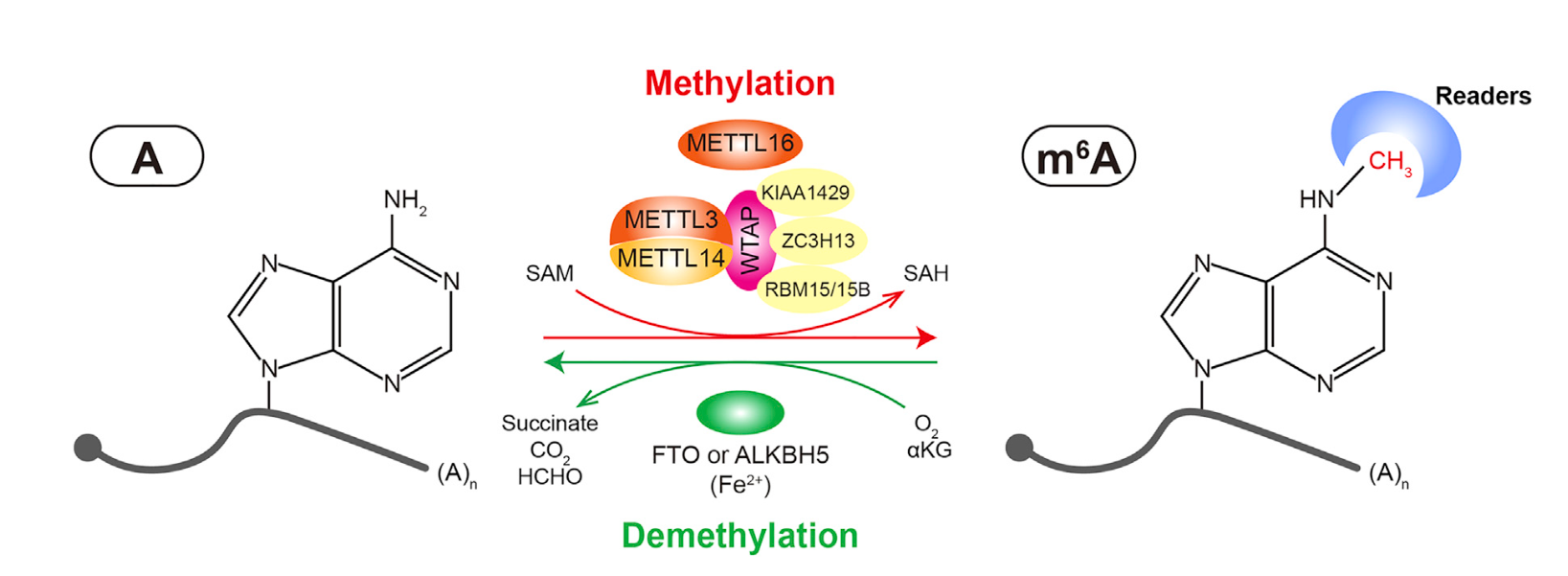
mRNA m6A修饰示意图
(Huang et al., 2020, Cancer Cell)
m6A修饰被认为是一种转录后修饰,mRNA上的m6A被认为主要位于终止密码子附近,且这一修饰过程是动态且可逆的。目前已发现与m6A修饰直接相关蛋白主要包括三大类:
1. 甲基转移酶(methyltransferase,又叫编写器,writers),包括METTL3-METTL14复合体及相关蛋白,它们能将底物S-腺苷甲硫氨酸上的甲基转移至mRNA上终止密码子附近的DRACH-motif(D代表A、G或U;R代表A或G;H代表A、C或U)中A的N6位以此完成m6A修饰;
2. 去甲基化酶(demethyltransferase,又叫擦除器,erasers),包括FTO和ALKBH5等,主要功能是去除RNA上的m6A修饰。其中FTO被发现作用于多种RNA,而ALKBH5被认为特异性地催化mRNA上m6A的去甲基化。
3. m6A结合蛋白(阅读器,readers)。YTH结构域包含蛋白如YTHDF1、2、3和YTHDC1、2,它们含有的YTH结构域能结合m6A修饰,它们是m6A修饰直接发挥效应的蛋白。值得注意的是,YTHDF1-3定位于细胞质,而YTHDC1定位于细胞核。
此前的研究已发现,m6A修饰相关蛋白例如甲基转移酶METTL14、去甲基化酶ALKBH5及m6A阅读蛋白YTHDF2对于AML维持干性至关重要。但是m6A修饰是如何直接影响mRNA从而决定AML疾病或正常细胞命运的机制仍然不得而知。
来自纪念斯隆凯特琳癌症中心(MSKCC, Memorial Sloan Kettering Cancer Center)的Kharas, M.G课题组的程远明博士后等人通过结合分子、细胞及生物信息学等手段发现:在AML及正常细胞中核内m6A阅读蛋白YTHDC1以液滴形式存在并保护其所结合的m6A修饰靶基因(MYC etc.)的mRNA减少被核内PAXT复合体降解从而稳定靶基因表达。
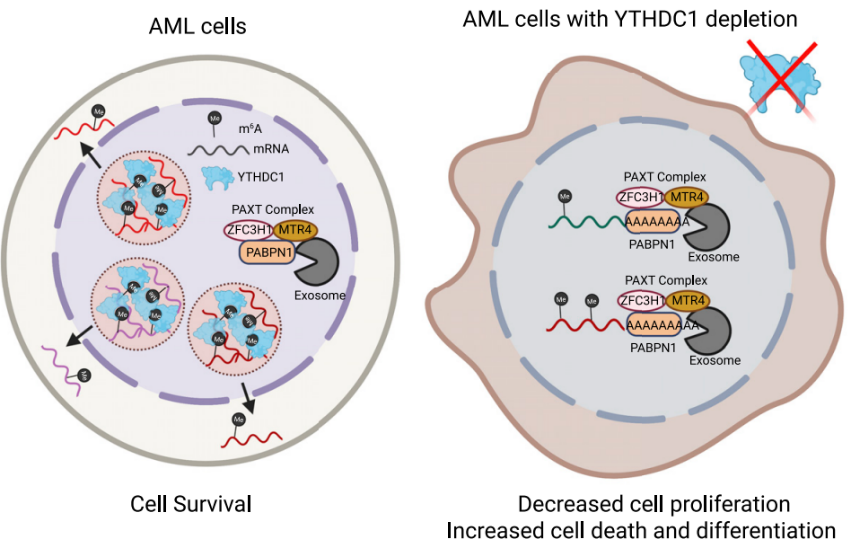
图一:(左)在急性髓系白血病细胞中YTHDC1与结合的m6A-mRNA在核内呈点状分布以保护靶基因如MYC-mRNA不被降解以维持细胞生存。(右)在急性髓系白血病细胞中敲除YTHDC1后,靶基因mRNA降解速度变快,蛋白减少,细胞增殖减少,细胞死亡与分化增加。
研究结论
一、YTHDC1在AML细胞中高表达且对其生存至关重要
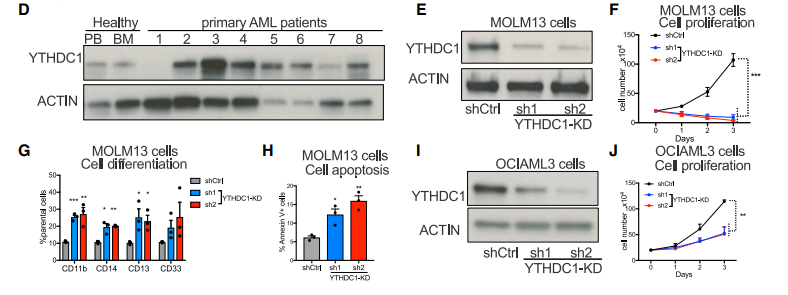
作者首先在之前已发表的对AML细胞系进行的Crispr筛选数据中寻找与m6A相关蛋白的得分情况,他们发现在筛选后的AML细胞RNA-seq中,YTHDC1-mRNA丰度在已知的m6A相关蛋白中是最低的,这暗示着YTHDC是AML细胞生存所需要的。
接着他们分析了公共数据库中YTHDC1在各种不同突变类型AML样本中的RNA表达水平高于正常样本,同时他们检测了YTHDC1在AML细胞系与正常人类脐带血来源的造血干细胞或祖细胞(CD34阳性代表HSPC,Hematopoietic stem and progenitors cells)及在AML病人样本和健康样本中的蛋白表达情况,均发现YTHDC1在疾病样本中的表达高于正常样本。
而后作者利用慢病毒包装的shRNA在不同类型的AML细胞株(MOLM13, OCIAML3)中敲低YTHDC1后发现AML细胞株的细胞增殖降低且AML细胞株的增殖和凋亡增加,同时将YTHDC1敲低的AML细胞与对照细胞移植进免疫缺陷性的小鼠,他们发现对于移植了敲低YTHDC1 AML细胞的小鼠其预后好于对照组小鼠,而在小鼠体内存活下来的细胞是那些并没有被敲低的AML细胞。以上数据表明YTHDC1对AML细胞的存活及发展至关重要。
YTHDC1是如何发挥功能的?发挥了怎样的功能?
二、YTHDC1蛋白在细胞核中呈点状分布且具有液相分离的特征
YTHDC1最早在1999年被鉴定出其能影响RNA剪接。而在2014年YTHDC1与m6A-mRNA复合体的晶体结构被正式解析,正式确信YTHDC1结合m6A-mRNA的能力。还有的研究发现敲除YTHDC1可能导致精子和卵泡发育异常或影响mRNA转运,另外他们还发现YTHDC1通过调控H3K9me3和异染色质形成来沉默逆转录转座子元件并维护细胞身份等。但这些功能难以解释YTHDC1作为极少数细胞核内m6A阅读蛋白对mRNA的直接调控能力。
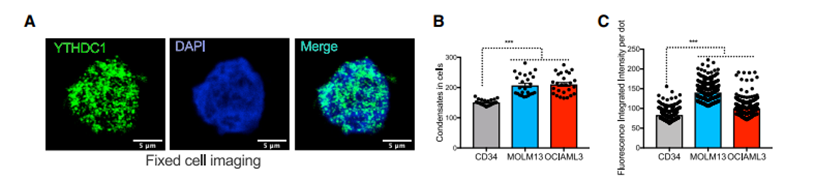
实际上之前的研究发现在BHK(Baby Hamster kidney)细胞中过表达YTHDC1时,它能在细胞核中呈点状分布。同时,作者结合氨基酸有序性分析发现YTH结构域包含蛋白家族包括YTHDF1-3除了含有识别m6A的YTH结构域外其N端或者C端都含有一段无序序列(IDRs,intrinsically disordered regions),而IDR被认为时蛋白质能形成相分离的重要特征。不出意外地,作者在对AML细胞中的YTHDC1蛋白进行染色时发现YTHDC1蛋白在细胞核中形成点状分布,而相对于在人类正常的HSPC中,YTHDC1蛋白在AML细胞核中形成的液滴更多且信号更强。
后续作者对YTHDC1蛋白的相分离性质进行了验证,他们体外纯化了YTHDC1蛋白并在试管中将YTHDC1蛋白与m6A修饰过的mRNA共同孵育后发现YTHDC1的点聚集能力增强,并且在体外环境下YTHDC1液滴能从荧光漂白中恢复,同时他们也发现YTHDC1液滴在试管中能相互融合。但光有体外数据不足以支撑YTHDC1蛋白在体内也具有液相分离的性质,于是作者利用Crispr系统构建了EGFP荧光蛋白标记内源YTHDC1的AML细胞株,并对内源YTHDC1蛋白进行荧光漂白发现其能从激光淬灭中恢复,以此证明了YTHDC1蛋白在细胞核内具有流动性。
YTHDC1所具有的相分离性质与其结合m6A的功能有关系吗?
三、YTHDC1与m6A结合的能力影响其相分离特性
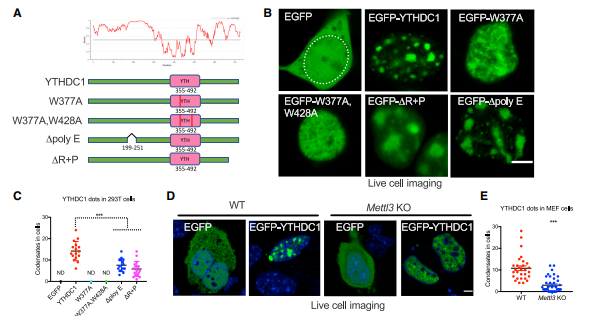
为了探究YTHDC1相分离性质及其与m6A修饰的mRNA结合的能力是否影响YTHDC1敲低对AML细胞生存的影响,作者根据之前已发表的YTH结构域与m6A-mRNA晶体结构数据构建了影响与m6A结合的YTHDC1W377A和YTHDC1W377A & W428A突变体。之前研究中提到的影响YTHDC1蛋白的关键氨基酸片段是N端polyE和C端R+P序列,作者同时也构建了相应的截短体。后续作者将其这些突变体与正常的YTHDC1过表达在了HEK293T细胞株中发现,当突变掉其与m6A结合所需的关键氨基酸后则不能在核内形成点状分布,而当截短N端的多聚谷氨酸或C端的富精氨酸和脯氨酸序列时截短体形成的核内液滴数目减少且变得不规则。
为了进一步确认是否真的是YTH突变引起YTHDC1不能结合m6A-mRNA而削弱了其相分离能力,作者构建了m6A甲基转移酶mettl3条件性敲除MEF细胞系,当敲除mettl3后理论上讲细胞中mRNA中m6A修饰水平应该严重下降,而后作者在其中过表达了EGFP融合的YTHDC1与对照EGFP,发现YTHDC1在mettl3敲除的MEF细胞核中形成液滴数量大幅减少,同时他们在体外纯化了这些蛋白并与m6A-mRNA共同孵育发现了更强的液滴形成能力且YTH突变体不能从荧光淬灭中恢复。
从功能上,作者进一步验证了IDRs或者m6A结合能力的突变是否影响YTHDC1的功能,由此,作者在YTHDC1敲除的AML细胞中过表达了抵抗shRNA敲低的野生型YTHDC1蛋白和突变体,而只有野生型的YTHDC1的过表达才能些许逆转YTHDC1敲除导致的AML细胞增殖降低、细胞分化变多,而无论是突变体或者截短体都不能逆转YTHDC1的敲除表型。由此,作者发现YTHDC1与m6A结合的能力影响其相分离能力,且这两者同时影响YTHDC1的功能。
那么YTHDC1具体而言是如何影响AML细胞生存的?
四、YTHDC1敲低导致MYC信号通路表达下降
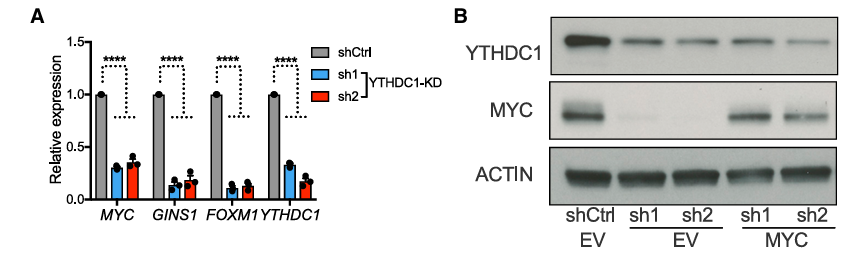
根据之前已经发现的YTHDC1可能影响RNA剪接和转运的结果来看,YTHDC1的敲除极有可能是引起了AML细胞中某些关键基因的表达、mRNA稳定性、转运或其他过程的异常,最直观的就是进行转录组测序。因此,作者对YTHDC1敲除的AML细胞进行了RNA-seq并发现有1320个基因表达下降,520个基因表达上升,而1320个表达下降的基因大多DNA复制、细胞周期有关,但实际上作者通过分析之前已发表的全基因m6A图谱和YTHDC1结合的m6A图谱数据发现在1320个下降基因中只有435个基因可能真正能与YTHDC1结合。后续作者对这些YTHDC1真正可能结合的基因进行了基因富集(GO,Genes Ontology)分析发现这些基因大量富集于MYC信号通路。由此,后续作者在细胞中对MYC-mRNA进行了原位杂交染色并同时对YTHDC1蛋白进行了免疫荧光染色证明这两者在细胞核内拥有不低的共定位(约40%)。随后,作者发现MYC总RNA和蛋白在YTHDC1敲低后均发生了下降,而过表达YTHDC1足以导致luc-MYC表达上升。此外,单纯的敲低MYC足以引起与YTHDC1敲低类似的细胞表型。
上述数据或许说明YTHDC1是通过直接结合关键基因例如MYC的m6A-mRNA并稳定其表达水平来影响AML细胞存活的,那么是如何实现的?后续作者为了阐述清楚这一点,将YTHDC1与目前已知的点状核体组分进行共染以探究其可能的作用,作者发现YTHDC1能和与剪接有关的SRSF2或与转录有关的超级增强子点BRD4有较高的共定位(大于30%)。那么YTHDC1是影响了MYC-mRNA剪接或者转录吗?
五、YTHDC1蛋白通过形成液滴保护关键靶基因MYC-mRNA不被降解

为了探究YTHDC1敲除对靶基因RNA转录的影响,作者利用qPCR检测了YTHDC1靶基因新生mRNA在YTHDC1敲低前后的表达水平,发现实际上YTHDC1所可能结合的靶基因转录水平并没有明显的变化(图五a),但在YTHDC1敲低后靶基因MYC-RNA的降解速度变快(图五b)。
先前的研究已发现在细胞核内,对于非编码RNA的降解来说是NEXT复合体介导的核外泌体(exosome)降解途径,而对于含有3'polyA的RNA来讲,是由PAXT(PolyA tail eXosome Target)介导的exosome降解途径。因此作者分别共染了exosome组分RRP6、PAXT复合体组分PABBN1、MTR4与MYC-RNA荧光原位杂交,并发现当YTHDC1敲低后MYC-RNA与这些RNA降解复合体的组分共定位升高(图五c-e)。后续作者发现在敲低YTHDC1后PABPN1所结合的MYC-RNA水平升高(原文图7g),且只有野生型的YTHDC1能部分逆转YTHDC1敲低所导致的MYC-RNA水平降低(原文图7h)。
作者通过以上实验证明:在急性髓系白血病细胞和人类造血干细胞中YTHDC1在核内呈点状分布,且在AML细胞中YTHDC1通过形成核内液滴以保护靶基因如MYC-mRNA不被PAXT介导的exosome降解以直接稳定靶基因表达维持细胞生存。
评论
该文章较为清晰的阐述了YTHDC1作为一个在AML中高表达的基因,在原来已知其是核内m6A阅读器的基础上,在细胞水平较为清晰的证明了其能在核内形成点状分布,而当敲除YTHDC1后靶基因mRNA降解速度更快从而影响细胞存活。
此外,此文在以下方面我有所疑惑或认为不足:
1. 为什么YTHDC1在AML样本中的表达量稍高?且从不同的WB数据来看(原文图1C,原文图4A),YTHDC1在人类健康来源的CD34阳性细胞中的表达量似乎不太稳定?
2. 整篇文章中仅有第一部分涉及部分PDX移植动物模型,需要更多动物数据以证明其观点。
3. 是不是可以对YTHDC1蛋白进行临近标记质谱实验以探明YTHDC1形成的液滴中到底存在哪些蛋白或RNA?至少作者没有直接证明YTHDC1所形成的液滴对其结合的靶基因具有保护作用(例如可以共染YTHDC1、PAXT与MYC-RNA原位杂交加上Z轴比较在YTHDC1点内外MYC-RNA与PAXT组分的共定位情况)。
4. 作者关注了YTHDC1敲低后下降那部分基因的功能,有无可能上升那部分基因也发挥了功能?例如在AML细胞中,YTHDC1结合这部分基因的m6A-mRNA导致其降解从而阻断分化或发育?
原文
Cheng Y, Xie W, Pickering BF, Chu KL, Savino AM, Yang X, Luo H, Nguyen DT, Mo S, Barin E, Velleca A, Rohwetter TM, Patel DJ, Jaffrey SR, Kharas MG. N6-Methyladenosine on mRNA facilitates a phase-separated nuclear body that suppresses myeloid leukemic differentiation. Cancer Cell. 2021 Jul 12; 39(7): 958-972.e8.